A meiose I do oócito de C. elegans envolve interações dinâmicas de estruturas celulares, e os pesquisadores descobriram um papel crítico para os microtúbulos na regulação da entrada da membrana durante a extrusão do corpo polar. Este processo é fundamental para manter a integridade do genoma durante a divisão celular, e as últimas descobertas revelam o delicado equilíbrio de forças necessárias para uma extrusão bem-sucedida do corpo polar.
O professor Bruce Bowerman do Instituto de Biologia Molecular da Universidade de Oregon, juntamente com Alyssa Quiogue, Dr. Chien-Hui Chuang, conduziram um estudo mostrando como os microtúbulos interagem com o córtex da actomiosina para garantir a divisão celular normal em oócitos de C. elegans. O estudo deles, publicado na revista especializada PLOS Genetics, fornece novos insights sobre os mecanismos da meiose I.
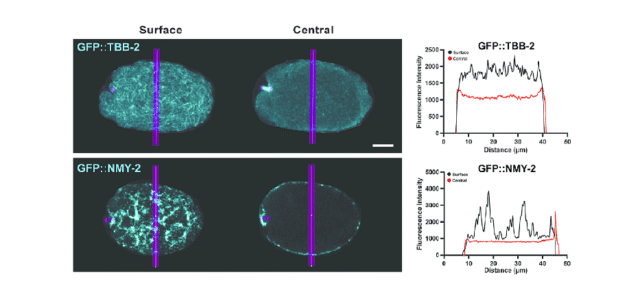
Durante a meiose I dos oócitos de C. elegans, um anel contrátil formado pela actomiosina cortical inicia a entrada na membrana, uma etapa crítica na extrusão do corpo polar. Os microtúbulos impedem essa entrada, criando um equilíbrio que evita a deformação excessiva da membrana do oócito, fundamental para a correta segregação cromossômica. O professor Bowerman explicou: “Nossos resultados sugerem que os próprios microtúbulos podem fornecer uma rigidez que neutraliza as forças geradas pela actomiosina cortical, presumivelmente através de alguma ligação cruzada entre eles ou com a actomiosina cortical, garantindo que a entrada na membrana seja regulada e não comprometa a integridade da célula.”
Os pesquisadores usaram técnicas avançadas de imagem, como imagens de células vivas e microscopia confocal de disco giratório, para rotular proteínas como CLS-2, KNL-1 e BUB-1 com marcadores fluorescentes para rastrear sua distribuição e interações em tempo real. Isso permitiu observar como a estabilidade dos microtúbulos afetada por tratamentos como nocodazol e paclitaxel afeta a invasão da membrana. “Nossos experimentos com paclitaxel e antecedentes genéticos mostram que o aumento da estabilidade dos microtúbulos associados ao córtex suprime os defeitos de entrada na membrana observados em oócitos mutantes CLS-2”, observou o professor Bowerman, sugerindo que a promoção da estabilidade dos microtúbulos pode corrigir defeitos de entrada durante a meiose.
Resultados importantes deste estudo incluem a observação de que a interrupção ou estabilização dos microtúbulos com nocodazol ou paclitaxel, respectivamente, resulta em alterações na invasão da membrana. Especificamente, a instabilidade leva à entrada excessiva, enquanto a estabilidade reduz a entrada excessiva. Estas descobertas destacam a importância de uma rede de microtúbulos bem regulada na divisão celular.
O estudo também destaca que, embora a dinâmica da actomiosina seja crítica, os microtúbulos subjacentes podem fornecer o suporte estrutural necessário para a entrada equilibrada da membrana, embora a sinalização indireta dos microtúbulos para a actomiosina não tenha sido descartada. Esta interação entre os microtúbulos e a actomiosina, seja direta ou indireta, é crítica para o funcionamento normal do anel contrátil que separa o corpo polar.
Em resumo, o professor Bowerman e colegas demonstram um papel importante dos microtúbulos na neutralização da invasão da membrana cortical induzida pela actomiosina durante a meiose I em C. elegans. Este equilíbrio garante que o córtex do oócito permaneça suficientemente rígido para permitir a divisão celular adequada e a extrusão do corpo polar, um processo crítico para a estabilidade genética do embrião em desenvolvimento.
Referência do diário
Quiogue AR, Sumiyoshi E, Fries A, Chuang CH, Bowerman B. “Os microtúbulos previnem a invasão da membrana cortical acionada pela actomiosina durante a extrusão do corpo polar da meiose I de Caenorhabditis elegans.” PLoS Genet, 2023. doi: https://doi.org/10.1371/journal.pgen.1010984