Os coágulos sanguíneos são uma das importantes ferramentas de sobrevivência do corpo. Eles fecham feridas, param de sangrar e nos ajudam a curar. Mas quando os coágulos sanguíneos se formam na hora errada ou no lugar errado, eles podem se tornar extremamente perigosos, levando a ataque cardíaco, acidente vascular cerebral ou danos repentinos a órgãos. O controle rígido da coagulação é crucial, e um dos guardiões mais importantes do corpo é uma proteína chamada antitrombina.
A antitrombina atua como um sistema natural de freio para a coagulação do sangue. Na maior parte do tempo, ele permanece silenciosamente inativo, aguardando um sinal. Esse sinal geralmente vem da heparina, um medicamento para afinar o sangue comumente usado em hospitais de todo o mundo. Os médicos sabem há anos que a heparina “ativa” a antitrombina, mas ainda não está claro exatamente como esse processo ocorre dentro da proteína. Um estudo recente teve como objetivo resolver esse enigma observando como os componentes internos da antitrombina se comunicam para acionar esse interruptor que salva vidas.
O Dr. Gonzalo Izaguirre, da Universidade de Illinois em Chicago e da Insight-DNA, descobriu agora uma resposta surpreendentemente elegante. Sua pesquisa foi publicada em revista internacional de ciências molecularesRevelou que a antitrombina contém um sistema de controle interno que bloqueia cuidadosamente a proteína na posição “desligada” até a hora certa.
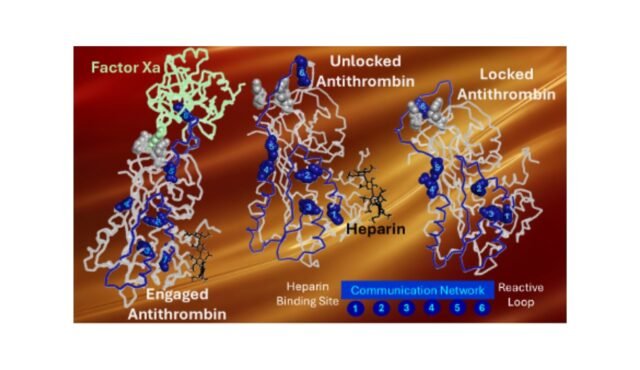
Usando modelagem computacional avançada, experimentos de proteínas cuidadosamente projetados e simulações que rastreiam o movimento em escala molecular, o Dr. Izaguirre identificou três pequenos componentes na antitrombina que agem como uma trava de segurança. Juntos, eles mantêm a proteína inativa. “Você pode pensar neles como uma fechadura”, explica ele. “Quando a heparina se liga, a fechadura se abre e toda a proteína muda de forma”.
Assim que a trava é liberada, a antitrombina entra em vigor imediatamente. Um movimento semelhante a um estalo em toda a sua estrutura permite-lhe desligar enzimas perigosas que formam coágulos, particularmente uma chamada factor Xa, que desempenha um papel importante na formação de coágulos sanguíneos. A equipe de pesquisa descobriu algo notável: mudar apenas uma parte da fechadura tornou a antitrombina mais ativa, mesmo na ausência de heparina. Mudar esses três abre tudo quase completamente. Isto mostra quão poderoso e preciso é realmente este sistema de controle interno.
Essas alterações não afetam apenas o desempenho da antitrombina, mas também a ação da antitrombina. Eles também alteram sua estabilidade física. Quando as mechas estão enfraquecidas, é mais provável que a proteína perca sua forma original, principalmente quando aquecida. “Isso nos diz que a proteína não quer mais permanecer num estado estático”, disse o Dr. Izaguirre. Em outras palavras, uma vez que a trava de segurança desaparece, a antitrombina está pronta para agir.
Outra característica importante da antitrombina é uma porção flexível chamada alça central de reação. Este anel é na verdade a parte que retém e desativa a trombina. Normalmente, ele é mantido no lugar por pequenas conexões internas, como pequenas ligações moleculares. Quando uma dessas ligações é quebrada, a circulação torna-se mais ativa, permitindo que a antitrombina responda mais rapidamente. A descoberta poderá ajudar os cientistas a conceber novas antitrombinas que sejam completamente independentes da heparina, um passo importante para os pacientes que não podem tomar o medicamento com segurança.
Para confirmar o que estavam vendo, os pesquisadores realizaram simulações computacionais detalhadas que lhes permitiram observar os movimentos da proteína. Um segmento interno chamado hélice F mostrou um movimento particularmente violento. Parece ser um mensageiro que transporta o sinal de ativação da região de ligação à heparina para o circuito de reação. “Vimos diferentes partes da proteína se tornando flexíveis ao mesmo tempo”, observou o Dr. Izaguirre. “Essa é uma forte indicação de que eles estão conversando.”
As implicações médicas são emocionantes. Ao revelar o processo de ativação passo a passo semelhante ao de um estilingue, este estudo explica como a heparina funciona em um nível mais profundo e aponta para alternativas mais seguras. Os tratamentos futuros poderão activar directamente a antitrombina, reduzindo a dependência da heparina e reduzindo o risco de efeitos secundários raros mas graves, tais como respostas imunitárias à heparina.
Finalmente, este estudo mostra que a antitrombina é mais do que um simples agente bloqueador de coágulos. É um interruptor molecular cuidadosamente projetado, completo com travas, alavancas e gatilhos que garantem que ele funcione apenas quando realmente necessário. Compreender como essa mudança funciona pode abrir caminho para uma nova geração de terapias para afinar o sangue e ajudar os médicos a navegar melhor na linha entre a cura e o dano.
Referência do diário
Izaguirre G. “Rede de comunicação alostérica em antitrombina ativada por heparina.” Revista Internacional de Ciências Moleculares, 2025;26(18):8984. faça: https://doi.org/10.3390/ijms26188984
Sobre o autor
Gonzalo IzaguirrePh.D., é bioquímico e cientista computacional com mais de trinta anos de experiência. Ele é especialista nos mecanismos moleculares que controlam a regulação da protease na saúde e nas doenças humanas. Nascido e criado na Cidade do México, ele estudou biologia na Universidade Nacional do México (UNAM) e recebeu seu doutorado em bioquímica pela Universidade de Maryland, College Park, seguido de pós-doutorado na Rutgers University e pesquisa na Robert Wood Johnson Medical School, em Nova Jersey, antes de ingressar na Universidade de Illinois, em Chicago, onde passou 24 anos. Sua carreira se concentrou na compreensão da biologia das serpinas, especificamente como as características estruturais determinam a especificidade inibitória, as transições conformacionais e a reatividade das serpinas (por exemplo, antitrombina) com suas proteases alvo. Izaguirre também fez contribuições significativas para o projeto e engenharia de inibidores seletivos baseados em serpina contra fatores de coagulação e membros da família da proproteína convertase (PC), enquanto sua pesquisa mais ampla elucidou as funções específicas de isoenzimas da PC no crescimento celular, diferenciação, progressão do câncer e entrada viral. Além de seu trabalho acadêmico, ele é o fundador da Insight-DNA, uma empresa de consultoria que fornece análise de dados baseada em inteligência artificial, suporte avançado em bioinformática e programas educacionais para ajudar instituições de pesquisa biomédica a adotar, integrar e aplicar efetivamente ferramentas de inteligência artificial. Por meio de modelagem estrutural, simulações de dinâmica molecular, análise de sequenciamento de próxima geração e treinamento em inteligência artificial translacional, o trabalho do Dr. Izaguirre une a bioquímica experimental com a inovação computacional para avançar no projeto racional de inibidores de protease e aprofundar nossa compreensão da regulação mediada por serpina em diversos sistemas biológicos.